LEY DE BOYLE MARIOTTE
Esta ley corresponde a la relación entre la presión y el volumen de un gas cuando la temperatura es constante.
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
En pocas palabras, se puede resumir que si la presión de un gas aumenta su volumen disminuye y viceversa.
Entonces, de esta ley se puede obtener la siguiente expresión matemática:
Donde "K" es una constante de proporcionalidad obtenida de los productos de la presión y el volumen.
-----------------------------------------------------------------------
Entonces, si "K" es una constante, se dice que en un gas cualquiera, con su número de moles constante, al multiplicar su actual volumen por su actual presión obtenemos una cantidad "K", y esa misma cantidad la obtendremos si modificamos su presión y multiplicamos la misma por el nuevo volumen adquirido. Siendo de este modo la fórmula:
Donde P1 y V1 son la presión y volumen iniciales del gas y P2 con V2 son la presión y volumen finales.
------------------------------------------------------------------------------
Ejemplo:
Se aumentó la presión de un gas hasta 2atm, pasando su volumen de 15L a 10L, cual era su presión inicial?
Como datos tenemos la presión final, el volumen inicial y el volumen final. Entonces requerimos de hacer un despeje en la fórmula para poder obtener la presión inicial del gas. Quedando de esta forma:
Realizando operaciones obtenemos que la presión inicial era de 1.333 atm.
Para comprobar multipliquemos las cantidades iniciales y luego las finales, si obtenemos el mismo número nuestra operación fue correcta.
P1 * V1 = K ... 1.33atm * 15L = 19.95
P2 * V2 = K ....... 2 atm * 10L = 20
En este caso nos quedó aproximado ya que el "1.33 atm" es un número periódico y no se usaron todos los decimales.
FUENTE DE CONSULTA:
* http://www.educaplus.org/gases/ley_boyle.html
* Apuntes de química.

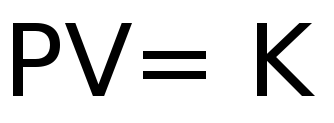


No hay comentarios.:
Publicar un comentario